原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种以胆汁淤积和胆管纤维化为特点的自身免疫性肝病,其病变由免疫介导的胆管细胞损伤引起,最终可能进展为肝硬化。虽然PBC的患病率较低(据估计PBC总体患病率为1.9/10万-40.2/10万),但在世界范围内其发病率正在上升。
《美国胃肠病学杂志》(影响因子:10.241)日前发表了一篇综述,详细论述了PBC的发病机制、自然史、临床及实验室表现和诊疗管理,本文即是对这篇综述主要内容的编译。
PBC的发病机制
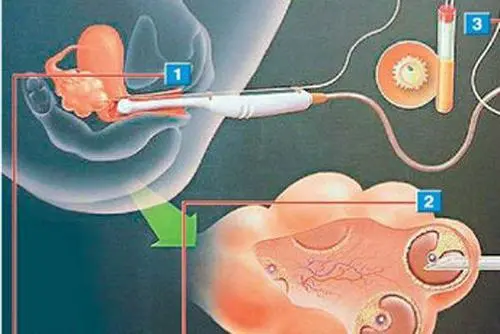
PBC的具体发病机理仍不清楚,其核心要点见图1。PBC的组织学特征是淋巴细胞性胆管炎造成的小叶内非化脓性胆管损伤。
图1 原发性胆汁性胆管炎(PBC)和原发性硬化性胆管炎(PSC)的发病机制概述
T细胞介导的攻击源于一些高表达基因,这些基因破坏了免疫耐受,增加了黏膜通透性,在持续的炎症和胆管反应中传递遗传和表观遗传因子。相应地,这种组织稳态的破坏和细胞外基质的持续沉积会导致纤维化、胆管缺失和门脉周围纤维化,最终导致肝硬化和终末期肝病。
PBC的自然史
PBC旧称“原发性胆汁性肝硬化”,但由于其炎性本质,以及在大多数情况下未进展为肝硬化,故改名为“原发性胆汁性胆管炎”。在过去的几十年中,早期诊断和更有效的药物治疗同时提高了PBC的生存率和患病率。
PBC的自然史分为4个阶段:
第一个阶段是临床前期,此时生物化学指标无明显异常,但可能存在PBC的组织学证据;
第二个阶段为无症状期,主要表现为生物化学指标异常,但没有明显临床症状;
第三阶段为症状期,患者出现乏力、皮肤瘙痒等临床症状,并可进展为肝硬化;
第四阶段为终末期,患者发生肝衰竭。
PBC的临床及实验室表现
大约50%的患者在诊断时是无症状的,而是由于体检时发现异常的生化指标。图2总结了PBC的基本临床表现和并发症。
图2 PBC的基本临床表现和并发症
PBC的诊断
符合下列三个标准中的两项即可诊断为PBC:
(1)碱性磷酸酶(ALP)水平持续6个月≥1.5×正常值上限;
(2)血清抗线粒体抗体(AMA)阳性,且滴度至少为1:40;
(3)非化脓性破坏性胆管炎和小叶间胆管损伤的组织学特征。
通常不需要肝活检来确诊。然而,当临床表现不一致或AMA阴性时,肝脏活检可能有助于确诊或排除诊断。
除AMA外,许多自身抗体在PBC患者中常见,当AMA阴性时(占PBC患者总数的5%)可能有助于诊断。抗gp210是进展为黄疸和肝衰竭的强预测因子,而抗着丝点抗体与门静脉高压的发生相关。抗sp100和抗sp210对PBC具有高度特异性。此外,PBC患者的血清IgM水平较高,是正常值上限的3至6倍,且与AMA滴度无关。
ALP升高可能反映胆汁淤积性疾病,也可能反映骨代谢的变化。维生素D缺乏和骨质疏松可能是脂溶性维生素吸收不良造成的。
PBC的管理
熊去氧胆酸(UDCA)是美国食品和药物管理局(FDA)批准的首个PBC治疗药物。其主要作用机制为促进胆汁分泌、抑制疏水性胆酸的细胞毒作用及其所诱导的细胞凋亡,因而保护胆管细胞和肝细胞。
剂量为13-15mg/kg/d的UDCA已被证明可延缓PBC的进展。在接受了UDCA治疗的患者中,约三分之二的患者生存期与普通人群相似。然而,三分之一的患者对UDCA治疗无应答,相较于获得治疗应答的患者,这些无应答患者的临床结局更差。
2016年,美国FDA批准奥贝胆酸(OCA)用于对UDCA无应答的PBC患者。OCA是一种法尼醇X受体(FXR)激动剂,其效力是内源性配体鹅去氧胆酸的100倍,通过FXR激活调节胆汁酸的合成、吸收、转运和分泌。OCA可显著降低PBC患者的血清ALP水平,其他肝生化指标和炎症指标也有一定改善,但瘙痒是OCA最严重的不良反应,且瘙痒发生呈剂量依赖性。
美国FDA批准的OCA起始剂量为5 mg/d,治疗3个月后,如果肝生化指标仍然异常且患者耐受良好,剂量可增加至10 mg/d。
图3总结了目前经过试验的药物及其证据质量。
图3 PBC和PSC治疗药物的证据状态
注:a:用于PBC和PSC的治疗药物;b:用于PBC症状的治疗药物